pH(ピーエイチ)
pH(ピーエイチ)
pH (ピーエイチ)の正式な名称は水素イオン濃度指数です。これは、水溶液の水素イオン 濃度を対数で表したものです。
水は、不純物を含まない純粋な状態でもわずかに電離してい て、H+ イオン濃度とOH-イオン濃度はそれぞれ1.0×10-7 mol/Lです。
ここに、外部か らH+ イオンやOH- イオンを加えても、H⁺とOH-イオン濃度の積は一定に保たれるという性質があり、これを電離平衡とよびます。
電離平衡を利用すれば、OH-イオンが主に存在するアルカリ性の溶液でも、H+ イオン濃度で水溶液の性質を表すことができます。
純粋な水のイオン濃度積から、以下の関係が成り立ちます。
[H+][OH] = 1.0 x 10-14 [mol/L²]
[H+]: 水素イオン濃度[mol/L],[OH]:水酸化物イオン濃度 [mol/L]
そこで、pHが下のように定義されました。
pH = -log ([H+])
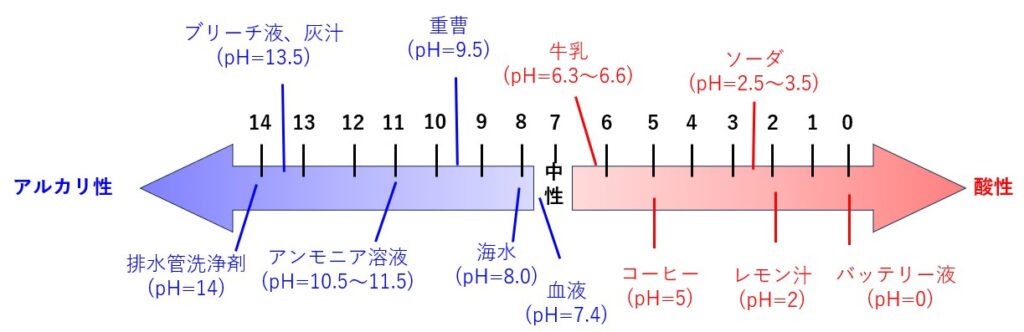
下図に、身近な物質のpHを示しました。
pHが対数なのは、われわれが目にする酸、 アルカリ水溶液の水素イオン濃度のヴァリエーションが、実際に14桁もある (pH0~14) からです。中性の水溶液のpHは7となります。
pHの意味についての話はこれくらいにして、pHが対数スケールであることを 忘れると陥りやすい間違いについて、確認しておきましょう。
例題5.22 pH 3.0の塩酸100mlとpH 5.0の塩酸100mlを混ぜると、混合溶液のpH はいくつになるか、電離度は1.0と考えてよい。
解答 (3.0+5.0)/2 = 4.0ではありません。ここは、正直に水素イオン濃度を計算してみ ましょう。
[H+] = 1.0 x 10 mol/L pH 3.0
[H+] = 1.0 x 105 mol/L pH 5.0
1.0 x 103 x 0.1 + 1.0 x 105 x 0.1 [H+] = 0.1+0.1
(5.63)
答:5.05×10-4 mol/L
pHは式 (5.62) から
共通
log Ans
答:pH=3.296708622
と出ます。
実は、上の問題は、pH 5.0の溶液の代わりに純水を使っても、混合溶液のpHはほとんど 同じです。なぜだかわかりますか?
また、log (2)=0.301と、答の3.296・・・の関係につい て説明してみてください。
付け加えると、上の問題は [H+]が10~7mol/Lよりずっと多いため、式 (5.61) の電離平 衡の影響を無視して考えています。
溶液のpHが7に近いときには電離平衡の影響が強く出て、計算はもっと複雑になります。
たとえば、pH=2の溶液を100倍に薄めれば pH=4 といってもよいですが、pH=6の溶液を100倍に薄めてもpH=8にはなりません。
pHが低いと



コメント